Практическая работа № 11
«Номенклатура и изомерия; способы получения, химические свойства»
Спирты. Фенолы. Альдегиды. Карбоновые кислоты.
Спирты – органические вещества, в состав которых входит одна или несколько гидроксильных групп, непосредственно связанных с насыщенным (находящимся в состоянии Согласно теории подобия, спирты можно рассматривать как производные воды (H−O−H), в которых один атом водорода замещен на органическую функциональную группу: R−O−H. Геометрически спирты также подобны молекуле воды. Например, угол R−O−H в молекуле метанола равен 109°, при этом гидроксильный кислород находится в состоянии sp³ гибридизации. За счет образующихся водородных связей спирты имеют существенно более высокие температуры плавления и кипения, чем можно было бы предполагать на основании физических свойств родственных соединений. Влияние гидроксильной группы сильно сказывается на физических свойствах спиртов- растворимости в воде, плотности, температурах кипения: соединения с небольшой длиной углеводородной цепи, например, метанол и этанол, неограниченно смешиваются с водой и имеют довольно высокие плотности и температуры кипения для своей молекулярной массы, в то время как высшие спирты гидрофобны и мало отличаются по свойствам от соответствующих углеводородов. Диссоциация атома водорода (то есть кислотный характер спиртов) зависит от поляризации С-О связи. Алкильный радикал оказывает донорный эффект на гидроксильную группу, тем самым ослабляя кислотные свойства спиртов: В целом кислотные свойства спиртов ослабевают с увеличением длины, то есть,молекулярной массы и разветвлённости углеводородной цепи: Спирты могут также вести себя как слабые основания Льюиса, образовывая с сильными минеральными кислотами соли алкоксония (например реакция замещения на галогены при взаимодействии с HHal) Таким образом, подобно воде спирты проявляют слабые кислотные и слабые основные свойства. Запомнить! 1. Неустойчивыми являются спирты, содержащие две гидроксильные группы при одном и том же атоме углерода. Такие соединения в результате перегруппировки превращаются в альдегиды или кетоны с отщеплением молекулы воды. 2. Неустойчивыми являются спирты, содержащие двойную связь (-ен) в молекуле у атома углерода, связанного с гидроксильной группой (-ол), то есть енолы. В результате перегруппировки (кето-енольная таутомерия) такие соединения также превращаются в альдегиды или кетоны. 1. По числу гидроксильных групп: Многоатомные спирты (полиспирты, полиолы) — органические соединения, содержащие в своём составе более одной гидроксильной группы. Большое значение многоатомные спирты имеют пищевой промышленности и химии полимеров. 2. По строению углеводородного радикала спирты подразделяются на 3. По типу атома углерода, с которым связана гидроксильная группа спирты классифицируют на По номенклатуре ИЮПАК названия простых спиртов образуются от названий соответствующих алканов с добавлением суффикса «-ол», положение которого указывается арабской цифрой. Алгоритм построения названий спиртов: 1. Выбирают самую длинную углеводородную цепь, содержащую гидроксильную группу. Она формирует базовое название (по числу атомов углерода). 2. Нумеруют цепь в таком направлении, чтобы гидроксильная группа получила наименьший номер в названии. Если в соединении имеются другие функциональные группы старше гидроксильной, то это правило применяется к старшей функциональной группе. 3. Старшая функциональная группа обозначается в виде суффикса (для гидроксильной "-ол"), а остальные заместители — в виде приставок в алфавитном порядке. Их положение в углеводородной цепи обозначается при помощи цифр — локантов, помещаемых после суффиксов и перед приставками. Для многоатомных спиртов перед суффиксом -ол указывается число гидроксильных групп (-диол, -триол, -тетраол и т. д.) . Для обозначения названий спиртов могут также использоваться рационально-функциональная и тривиальная номенклатура. Так, в соответствии с рациональной номенклатурой название образуется от названия класса соединения (спирт) с добавлением названий радикалов, присоединённых к гидроксильной группе, например: этиловый спирт - Для спиртов характерны следующие виды изомерии: Молекулы спиртов, имея в своей структуре гидроксильную группу, способны образовывать межмолекулярные водородные связи (подобны воде). Спирты растворимы в большинстве органических растворителей, первые три простейших представителя – метанол, этанол и пропанол, а также третичный бутанол Поэтому предельные неразветвленные спирты состава Все спирты легче воды, так как имеют плотность меньше единицы Низшие спирты неограниченно смешиваются с водой. Низшие спирты имеют приятный «спиртовый» запах, средние обладают неприятным запах, высшие запахом не обладают.Cтроение спиртов
Диссоциация и кислотно-основные свойства спиртов




 ;
; 


НОМЕНКЛАТУРА СПИРТОВ


ИЗОМЕРИЯ СПИРТОВ

ФИЗИЧЕСКИЕ СВОЙСТВА СПИРТОВ
Ароматические спирты. Фенолы
гомология и изомерия ароматических спиртов и фенолов
Ароматические спирты и фенолы относятся к гидроксипроизводным аренов.

Напомним, что согласно определению, данному в теме "Строение, классификация и номенклатура спиртов", спиртами считаются органические вещества, содержащие одну или более гидроксильных групп (−OH), непосредственно связанных с насыщенным (находящимся в состоянии
Таким образом:
Одноатомные ароматические спирты - это соединения, в которых гидроксильная группа находится в "боковой цепи", то есть не связана непосредственно с бензольным ядром.

Первым представителем ряда одноатомных ароматических спиртов является бензиловый спирт, или фенилметанол. У других представителей этого ряда боковая углеродная цепь может иметь линейное (фенилэтанол или фенитиловый спирт) или, начиная с фенилпропанола, - разветвленное строение (изомерия углеродного скелета). Кроме того, возможна изомерия положения гидроксильной группы в цепи.
Если гидроксильная группа связана с ненасыщенным (
Фенолы - производные ароматических углеводородов, в молекулах которых гидроксильная группа (- ОН) непосредственно связана с атомами углерода в бензольном кольце.
Таким образом, «фенолы» относятся к классу енолов, поскольку в их молекулах гидроксильная группа -ОН связана непосредственно с бензольным или другим ароматическим циклом, в котором все атомы углерода находятся в
В зависимости от количества ОН-групп в молекуле, различают одно-, двух-, трехатомные фенолы. Наиболее известные из них:

В структуре фенолов могут присутствовать другие заместители, например, алкильные радикалы. Для замещенных фенолов характерна изомерия углеродного скелета боковой цепи, изомерия расположения заместителей в бензольном кольце.

Для фенолов характерна также изомерия боковой цепи (строения алкильного радикала и числа радикалов).
К фенолам также относятся соединения, имеющие в своей структуре конденсированные бензольные кольца: двухядерные нафтолы (производные нафталина), и трехядерные - антранолы (производные антрацена) и фенантролы (производные фенантрена):

Номенклатура ароматических спиртов и фенолов
Для составления названия ароматических спиртов используются правила международной (систематической) номенклатуры, при этом главной является цепь, содержащая гидроксильную группу, а бензольное ядро представляется собой заместитель (радикал - фенил). В соответствии с правилами систематической номенклатуры:
- углеводородную цепь нумеруют с того конца, к которому ближе расположена ОН-группа,
- далее используют эту нумерацию, чтобы указать положение различных заместителей вдоль основной цепи,
- в конце названия добавляют суффикс «ол» и цифру, указывающую положение ОН-группы.
Например, ароматический спирт, имеющий структурную формулу
Для фенолов широко используют тривиальные названия, сложившиеся исторически, например:

В названиях замещенных моноядерных фенолов используются также приставки орто-, мета- и пара-, употребляемые в номенклатуре ароматических соединений.


Для более сложных соединений, в соответствии с систематической номенклатурой, нумеруют атомы, входящие в состав ароматических циклов и с помощью цифровых индексов указывают положение заместителей:


особенности электронного Строение фенола
В молекуле фенола фенильный радикал

Гидроксильная группа -ОН обладает отрицательным индуктивным эффектом -I, но за счет того, что неподеленная электронная пара атома кислорода притягивается общим
За счет результирующего отрицательного эффекта в бензольном кольце нарушается симметричность электронного облака,
Физические свойства
Большинство одноатомных фенолов при нормальных условиях представляют собой бесцветные кристаллические вещества с невысокой температурой плавления и характерным запахом.
Фенолы малорастворимы в воде, хорошо растворяются в органических растворителях, токсичны, при хранении на воздухе постепенно темнеют в результате окисления.
Фенол

При обычной температуре фенол ограниченно растворим в воде, но при нагревании выше
Токсические свойства фенола
Фенол — токсичное вещество, вызывает ожоги кожи, является антисептиком, вызывает нарушение функций нервной системы. Пыль, пары и раствор фенола раздражают слизистые оболочки глаз, дыхательных путей, кожу. Попадая в организм, фенол очень быстро всасывается даже через неповрежденные участки кожи и уже через несколько минут начинает воздействовать на ткани головного мозга, вызывая паралич дыхательного центра. Даже при воздействии минимальных доз фенола наблюдается чихание, кашель, головная боль, головокружение, бледность, тошнота, упадок сил. В некоторых случаях фенол является причиной онкозаболеваний, так как обладает канцерогенным эффектом.
Альдегиды
Альдегиды и кетоны относятся к классу органических кислородсодержащих, а именно - карбонильных соединений, то есть содержат карбонильную группу -C(O)-. Альдегиды и кетоны также называют оксосоединениями, карбонильную группу - оксо-группой.

Альдегиды
Название "альдегид" было введено Юстусом фон Либихом как сокращение от латинского alcohol dehydrogenatus — дегидрированный спирт или спирт, лишенный водорода. Название радикала "формил", а также другие однокоренные слова (формальдегид, формиаты) произошли от латинского слова formica — "муравей".
Простейший альдегиды (метаналь, этаналь) - газы, альдегиды состава (
Альдегидная группа содержится во многих природных веществах, таких, как углеводы, некоторые витамины (ретиналь, пиридоксаль). В небольших количествах альдегиды содержатся в эфирных маслах и часто способствуют их приятному запаху, например, коричный альдегид, бензальдегид, цитраль и ванилин. Запах жасмина и розы также обусловлены присутствием в эфирных маслах соответствующих альдегидов и кетонов.
Альдегид, кетон название | Формула | Запах |
|---|---|---|
| бензальдегид |
| горького миндаля
|
| коричный альдегид |
| корицы
|
| ванилин |
| ванили
|
| жасмон |
| жасмина
|
| цитраль |
| цитрусовых
|

Впервые синтетический альдегид был использован в 1921 году при создании легендарного аромата Chanel №5, в который входили соединения из группы так называемых жирных альдегидов, обладающие характерным цитрусовым или цветочным запахом и своеобразными "мыльными" полутонами.
Сегодня наиболее часто в парфюмерии используют следующие альдегиды:
- C7 - гептаналь, обладающий «зеленым», травянистым запахом;
- C8 - октаналь, апельсиновый запах;
- C9 - нонаналь, запах розы;
- C10 - деканаль, запахом напоминает цедру апельсина; цитраль, более сложный альдегид с запахом лимона;
- C11 - ундеканаль , «чистый» альдегид, содержащийся в масле листьев кориандра;
- C12 - лауриловый альдегид с запахом сирени или фиалки;
- C13 - восковой запах с грейпфрутовой нотой;
- C14 - ундекалактон, соединение с характерным запахом персика, использовавшееся, в частности, при создании легендарного аромата Guerlain Mitsouko.
Низшие альдегиды - формальдегид (метаналь) и уксусный альдегид (этаналь) обладают токсичными свойствами. Так, уксусный альдегид является продуктом неполного окисления алкоголя (этилового спирта) в организме человека и образуется при чрезмерном употреблении спиртных напитков. Именно он является виновником "похмельного синдрома". Формальдегид может выделяться в окружающую среду при разложении фенолформальдегидных смол (основа ДСП - древесностружечных плит, из которых производят мебель и некоторые строительные материалы), и может вызывать сильные отравления, онкологические заболевания, поражение центральной нервной системы. Поэтому формальдегид является экотоксикантом и относится ко II классу опасности (высокоопасные соединения).
СТРОЕНИЕ И КЛАССИФИКАЦИЯ АЛЬДЕГИДОВ
По определению ИЮПАК:
Альдегиды — класс органических соединений вида R-C(О)H, в которых карбонильная группа -С(О)- связана с одним атомом водорода и одним углеводородным радикалом R. При этом группа -С(О)Н называется альдегидной группой.
Общая формула предельных одноатомных альдегидов
Строение альдегидной группы
Свойства альдегидов определяются строением альдегидной группы. Атом углерода в карбонильной группе находится в состоянии

Двойная связь карбонильной группы сходна по физической природе с двойной связью между углеродными атомами, однако в то же время энергия связи С=О (749,4 кДж/моль) больше, чем энергия двух простых связей (2×358 кДж/моль) C-O. С другой стороны, кислород является более электроотрицательным элементом, чем углерод, и потому электронная плотность вблизи атома кислорода больше, чем вблизи атома углерода. Длина связи С=О составляет 0,122 нм
Классификация альдегидов
Альдегиды классифицируются по нескольким признакам:
1. В зависимости от насыщенности углеводородного заместителя:
- предельные (насыщенные) альдегиды (ацетальдегид);
- непредельные (ненасыщенные) альдегиды (акролеин);
- ароматические альдегиды (бензальдегид).
2. В зависимости от числа карбонильных групп:
- альдегиды с одной карбонильной группой (формальдегид);
- диальдегиды (глиоксаль);
- многоатомные альдегиды.
НОМЕНКЛАТУРА И ИЗОМЕРИЯ АЛЬДЕГИДОВ
В соответствии с международной (систематической) номенклатурой ИЮПАК названия простых альдегидов образуются от названий соответствующих алканов с добавлением суффикса -аль (для диальдегидов — суффикса -диаль). Помимо систематической номенклатуры, для обозначения альдегидов широко используются тривиальные названия:

При составлении названия альдегидов по систематической номенклатуре нужно помнить ряд правил:
1. Если альдегидная группа в соединении одна, то она всегда занимает крайнее положение, и поэтому в названии альдегида номер при альдегидной группе, как правило, не ставят.
2. Если карбонильная группа не входит в родоначальную структуру (например, если родоначальной структурой является циклический углеводород или гетероцикл), то к названию добавляется суффикс -карбальдегид.
3. Если в соединении альдегидная группа не является старшей, то в таких случаях её обозначают используя приставку формил-, указывая её положение :

Для альдегидов характерна следующие виды изомерии:
- изомерия углеродного скелета (начиная с С4)

- межклассовая изомерия (с кетонами)

ФИЗИЧЕСКИЕ СВОЙСТВА АЛЬДЕГИДОВ
В альдегидах водородные связи более слабые, чем в спиртах. Сравним полярность связей -O-H и -С-H, частичный положительный заряд на водороде гидроксильной группы больше, чем на водороде карбонильной группы, так как разница в электроотрицательности между кислородом и водородом больше, чем между углеродом и водородом. Поэтому из всех альдегидов с одной карбонильной группой только формальдегид представляет собой газообразное при комнатной температуре вещество. Альдегиды С2 - С12 — жидкости, а альдегиды нормального строения с более длинным неразветвлённым углеродным скелетом, являются твёрдыми веществами. Температуры кипения альдегидов с неразветвлённым строением углеродной цепи выше, чем у их изомеров. Они кипят при более низких температурах, чем спирты с тем же числом углеродных атомов, например, пропионовый альдегид кипит при

Формальдегид и ацетальдегид практически неограниченно смешиваются с водой, однако, с ростом длины углеродного скелета, растворимость альдегидов в воде сильно уменьшается, например, растворимость гексаналя при
КЕТОНЫ
Слово кетон произошло от старого немецкого слова Aketon (ацетон). Придумал его в 1848 году немецкий химик Леопольд Гмелин (1788—1853), однако первый кетон - ацетон был открыт Робертом Бойлем еще в 1661 году при нагревании ацетата кальция (ацетон происходит от лат. acetum — уксус):
Кетоны — органические вещества, в молекулах которых карбонильная группа связана с двумя углеводородными радикалами.
Общая формула кетонов:
Карбонильная группа -С(О)- в кетонах также часто называется кето-группой.
НОМЕНКЛАТУРА И ИЗОМЕРИЯ КЕТОНОВ
В соответствии с международной номенклатурой, названия алифатических и алициклических кетонов образуют, прибавлением суффикса -он или -дион (для дикетонов) к названиям родоночальных углеводородов, в которых длина цепи отображается корнем слова (проп-, бут- и т.д.).
Например:
Самым коротким кетоном является ацетон или пропанон. Для более длинных УВ-цепей (начиная с С5) в конце названия указывается месторасположение кето-группы:
Дикетоны ароматического ряда с кетонными группами в ядре называют сокращённым названием углеводорода, добавляя суффикс -хинон.

Часто используются названия кетонов, образованные в соответствии с радикально-функциональной номенклатурой, при этом название составляется из радикалов, расположенных при кетогруппе (указываются в алфавитном порядке) и названия класса соединений (функции) -кетон. Например, метилэтилкетон (бутанон) —
Для простейших кетонов используются их тривиальные названия, например, ацетон (для 2-пропанона) и бензофенон (для дифенилкетона).
Для кетонов, также как и для альдегидов с одной альдегидной группой, характерны:
- изомерия углеродного скелета:

- изомерия положения функциональной группы:

- межклассовая изомерия - с альдегидами, непредельными спиртами и непредельными простыми эфирами:

Физические свойства кетонов представлены ранее в таблице в разделе "Физические свойства альдегидов".
И альдегиды. и кетоны - полярные вещества с избыточной электронной плотностью на атоме кислорода. Температуры кипения альдегидов и кетонов ниже, чем у соответствующих спиртов. Это связано с низкой подвижностью атома водорода в альдегидах и отсутствием такого атома в кетонах, и, соответственно невозможностью образовывать водородные связи.
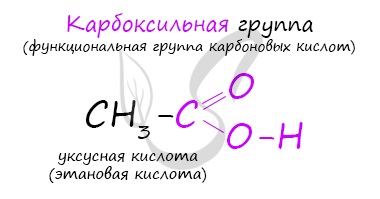
Карбоновые кислоты
Карбоновые кислоты - класс органических соединений, молекулы которых содержат одну или несколько карбоксильных групп COOH.
Имеют разнообразное промышленное применение и большое биологическое значение. Общая формула одноосновных карбоновых кислот CnH2nO2 .
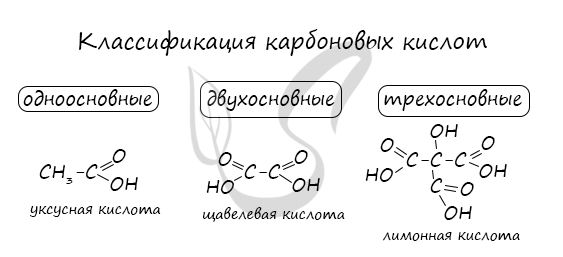
Классификация карбоновых кислот
По количеству карбоксильных групп в молекуле карбоновые кислоты подразделяются на:
- Одноосновные - 1 карбоксильная группа
- Двухосновные - 2 карбоксильных группы
- Трехосновные - 3 карбоксильных группы
Высшие карбоновые кислоты называют жирными кислотами. Более подробно мы изучим их теме, посвященной жирам, в состав которых они входят.
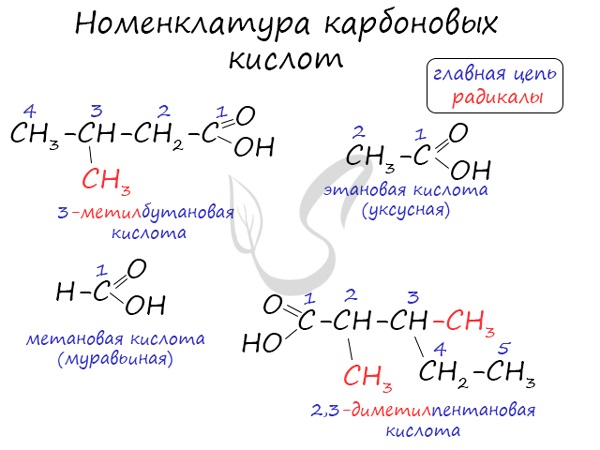
Номенклатура и изомерия карбоновых кислот
Названия карбоновых кислот формируются путем добавления суффикса "овая" к названию алкана с соответствующим числом атомов углерода и слова кислота: метановая кислота, этановая кислота, пропановая кислота, и т.д.
Многие карбоновые кислоты имеют тривиальные названия. Наиболее известные:
- Метановая - HCOOH - муравьиная кислота
- Этановая - CH3-COOH - уксусная кислота
- Пропановая - C2H5-COOH - пропионовая кислота
- Бутановая - C3H7-COOH - масляная кислота
- Пентановая - C4H9-COOH - валериановая кислота
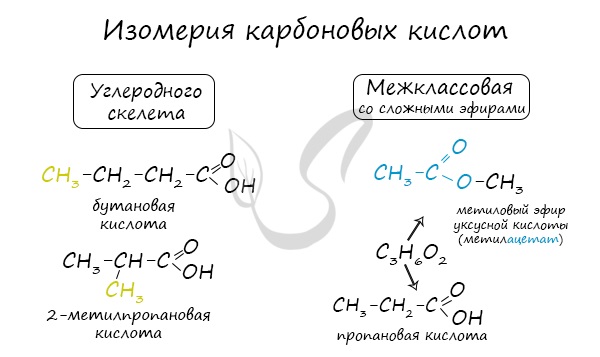
Для предельных карбоновых кислот характерна структурная изомерия: углеродного скелета, межклассовая изомерия со сложными эфирами.
Получение карбоновых кислот
- Окисление алканов
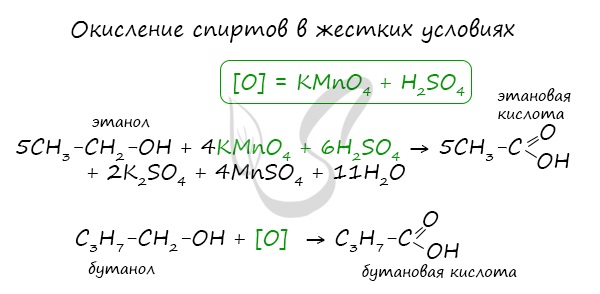
- Окисление спиртов
- Окисление альдегидов
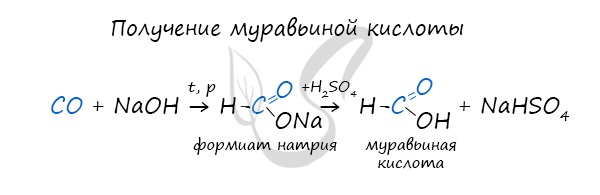
- Синтез муравьиной кислоты
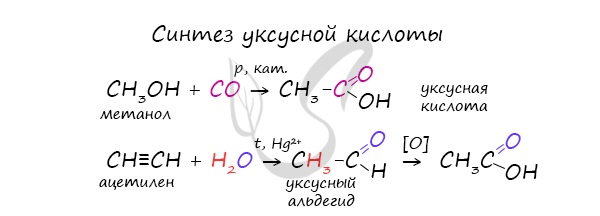
- Синтез уксусной кислоты
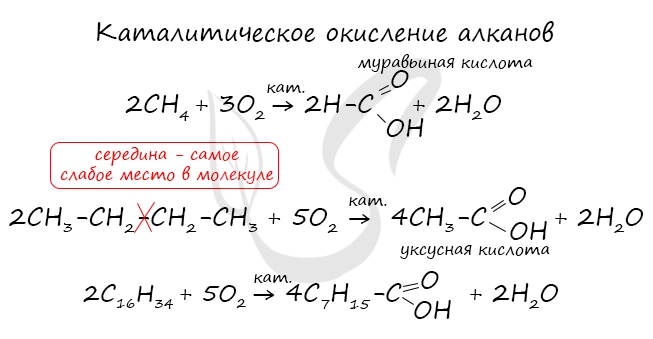
При повышенной температуре и в присутствии катализатора становится возможным неполное окисление алканов, в результате которого образуются кислоты.
При реакции спиртов с сильными окислителями, такими как подкисленный раствор перманганата калия, спирты окисляются до соответствующих кислот.
При окислении альдегиды образуют соответствующие карбоновые кислоты. Окисление можно проводить качественной реакцией на альдегиды - реакцией серебряного зеркала.

Обратите особое внимание, что при написании реакции с аммиачным раствором серебра в полном виде, правильнее будет указать не кислоту, а ее аммиачную соль. Это связано с тем, что выделяющийся аммиак, который обладает основными свойствами, реагирует с кислотой с образованием соли.

Окисление альдегидов также может быть успешно осуществлено другим реагентом - свежеосажденным гидроксидом меди II. В результате такой реакции образуется осадок кирпично-красного цвета оксида меди I.

Существует специфический способ получения муравьиной кислоты, который заключается в реакции щелочи с угарным газом - образуется формиат (соль муравьиной кислоты). В результате добавления раствора серной кислоты к формиату получается муравьиная кислота.
Специфичность синтеза уксусной кислоты заключается в реакции угарного газа с метанолом, в результате которой она образуется.
Также уксусную кислоту можно получить другим путем: сначала провести реакцию Кучерова, в ходе которой образуется уксусный альдегид. Окислить его до уксусной кислоты можно аммиачным раствором оксида серебра или гидроксидом меди II.
Химические свойства карбоновых кислот
Для карбоновых кислот не характерны реакции присоединения. Карбоновые кислоты обладают более выраженными кислотными свойствами, чем спирты.
- Кислотные свойства
- Галогенирование
- Особые свойства муравьиной кислоты
- Разложение муравьиной кислоты
Карбоновые кислоты вступают в реакции с металлами, которые способны вытеснить водород (стоят левее водорода в ряду напряжений металлов) из кислоты. Реагируют также с основаниями, с солями более слабых кислот, например, угольной кислоты.

Галогенирование происходит по типу замещения в радикале, который соединен с карбоксильной группой. Напомню, что наиболее легко замещается водород у третичного, чуть сложнее - у вторичного, и значительно сложнее - у первичного атома углерода.

Сила карбоновых кислот тем выше, чем меньше электронной плотности сосредоточено на атоме углерода в карбоксильной группе. Поэтому самая слабая из трех кислот - уксусная, чуть сильнее - хлоруксусная, за ней - дихлоруксусная и самая сильная - трихлоруксусная.
Перераспределение электронной плотности в молекулах этих кислот для лучшего запоминания лучше увидеть наглядно. Это перераспределение обусловлено большей электроотрицательностью хлора, который притягивает электронную плотность.

Муравьиная кислота отличается от своих гомологов. За счет наличия у нее альдегидной группы, она, единственная из карбоновых кислот, способна вступать в реакцию серебряного зеркала.
В такой реакции идет ее окисление до нестойкой угольной кислоты, которая распадается на углекислый газ и воду.

При нагревании и в присутствии серной кислоты (водоотнимающего компонента) муравьиная кислота распадается на воду и угарный газ.
HCOOH → (t, H2SO4) CO↑ + H2O
Непредельные карбоновые кислоты
Распределение электронной плотности в молекулах творит чудеса: иногда реакции идут против правила Марковникова. Так происходит в непредельной акриловой кислоте.
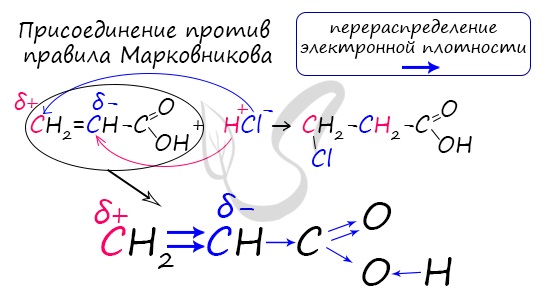
Ход работы:
ВАРИАНТ 1
Инструкция по выполнению работы
Работа состоит из двух частей и включает 14 заданий. Часть А включает 10 заданий (А1-А10). К каждому заданию дается 4 варианта ответа, из которых - только один правильный.
Часть В (В1-В4) состоит из четырех заданий, для которых нужно дать ответ в виде числа или в виде набора цифр, записав их последовательно, без пробелов. В задании В4 решите задачи.
За выполнение различных по сложности заданий дается один (часть А), два (часть В) балла, которые затем суммируются. Постарайтесь набрать как можно больше баллов.
ЧАСТЬ А
А1. Общая формула предельных одноатомных спиртов
1) СnH2n+1OH 2) СnH2nO 3) СnH2n+2 4) СnH2n(OH)2
А 2. Функциональной группой карбоновых кислот является
1) гидроксогруппа 2) карбонильная группа 3) карбоксильная группа 4) аминогруппа
А 3. Название вещества, формула которого СН3─СOOH
1) ацетальдегид 2) уксусная кислота 3) этанол 4) муравьиная кислота
А 4. Вещества СН3 – СН2 –СООН и СН3 –СООН являются
1) структурными изомерами 2) изомерами по положению функциональной группы
3) гомологами 4) альдегидами
А 5. Сумма коэффициентов в уравнении реакции горения метанола
1) 9 2) 6 3) 8 4) 11
А 6. Этанол взаимодействует с
1) уксусной кислотой 2) метаном 3) водородом 4) лакмусом
А 7. Уксусная кислота может реагировать с
1) серебром 2) магнием 3) метаном 4) медью
А 8. При взаимодействии альдегидов с водородом в присутствии катализатора при нагревании образуются
1) углеводороды 2) карбоновые кислоты 3) арены 4) спирты
А 9. В схеме С2Н6 → Х → С2Н5ОН веществом «Х» является
1) С2Н5 ─ O ─ C2H5 2) С2Н2 3) С2Н5Br 4) СН3ОН
А 10. Реакция с аммиачным раствором оксида серебра (I ) характерна для
1) пропанола -1 3) пропионовой кислоты
2) прапаналя 4) этандиола
ЧАСТЬ В
В 1.Установите соответствие между формулой вещества и его названием
ФОРМУЛА ВЕЩЕСТВА | НАЗВАНИЕ ВЕЩЕСТВА |
A) С2H5OH | 1) ацетальдегид |
Б) CH3COOH | 2) пропионовая кислота |
В) CH3- CH2 -COOH | 3) этановая кислота |
Г) CH3CHO | 4) этиловый спирт |
А | Б | В | Г |
Ответ (набор цифр без пробелов): ________________
В 2.Установите соответствие между названием вещества и классом (группой) органических соединений, к которому оно принадлежит (цифры могут повторяться):
НАЗВАНИЕ ВЕЩЕСТВА | КЛАСС (ГРУППА) ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ |
А) этиловый спирт Б) глицерин В) 2-метилбутанол-1 Г) формальдегид | 1) алканы |
2) предельные одноатомные спирты | |
3) альдегиды | |
4) сложные эфиры | |
5) карбоновые кислоты | |
6) многоатомные спирты |
А | Б | В | Г |
Ответ (набор цифр без пробелов): ________________
В 3. Для предельных одноатомных спиртов характерны реакции
1) этерификации
2) взаимодействие с активными металлами
3) окисления
4) дегидратации
5) гидратации
6) полимеризации
В 4. Решите задачи
Задача №1. Объем водорода, который выделится при взаимодействии 4,6 г натрия с этиловым спиртом, равен _____________ л. (Ответ записать в виде целого числа с точностью до сотых).
Задача №2. В двух пробирках находятся вещества: глицерин и ацетальдегид. Как распознать каждое из веществ? Напишите уравнения реакций.
Инструкция по выполнению работы
На выполнение данной работы отводится 40 мин. Работа состоит из двух частей и включает 14 заданий. Часть А включает 10 заданий (А1-А10). К каждому заданию дается 4 варианта ответа, из которых - только один правильный.
Часть В (В1-В4) состоит из четырех заданий, для которых нужно дать ответ в виде числа или в виде набора цифр, записав их последовательно, без пробелов. В задании В4 решите одну из задач.
Внимательно прочитайте каждое задание и предлагаемые варианты ответа. Отвечайте только после того, как вы поняли вопрос и проанализировали все варианты ответа.
За выполнение различных по сложности заданий дается один (часть А), два (часть В) балла, которые затем суммируются. Постарайтесь набрать как можно больше баллов. Желаем успеха!
ЧАСТЬ А
При выполнении заданий этой части (А1-А10) выберите только один из четырёх предложенных вариантов ответа. В бланке ответов выполняемого вами задания
поставьте знак « Х » в клеточку, номер которой соответствует номеру выбранного вами ответа.
А1. Общая формула одноосновных карбоновых кислот
1) R -COOH 2) R - OH 3) RCHO 4) R- O - R
А 2. Функциональной группой спиртов является
1) гидроксогруппа 2) карбонильная группа 3) карбоксильная группа 4) аминогруппа
А 3. Название вещества, формула которого НСOOH
1) ацетальдегид 2) уксусная кислота 3) этанол 4) муравьиная кислота
А 4. Вещества СН3 – СН2 –ОН и СН3 –ОН являются
1) структурными изомерами 2) изомерами по положению функциональной группы
3) гомологами 4) альдегидами
А 5. Сумма коэффициентов в уравнении реакции гидратации ацетилена в присутствии солей ртути (реакции Кучерова)
1) 4 2) 3 3) 8 4) 2
А 6. Альдегиды не взаимодействуют с
1) водородом 2) гидроксидом меди (II)
3) аммиачным раствором оксида серебра (I) 4) метаном
А 7. Многоатомным спиртом является
1) этанол 2) этилен 3) этиленгликоль 4) этилацетат
А 8.Верны ли следующие суждения о свойствах веществ?
А.Уксусная кислота – слабая кислота.
Б.При окислении альдегидов получаются карбоновые кислоты.
1) верно только суждение А 2) верно только суждение Б
3) оба суждения верны 4) оба суждения неверны
А 9. В схеме С2Н2 → Х → СН3СООН веществом «Х» является
1) метан 2) бензол 3) уксусный альдегид 4) масляная кислота
А 10. Этанол можно получить из этилена в результате реакции
1) гидратации 3) галогенирования
2) гидрирования 4) гидрогалогенирования
Часть В
Ответом к заданиям части В является набор цифр или число, которые следует записать в бланк ответов № 1 справа от номера соответствующего задания, начиная с первой клеточки.
В заданиях В1-В3 на установление соответствия к каждой позиции первого столбца подберите соответствующую позицию второго и запишите в таблицу выбранные цифры под соответствующими буквами. Затем получившуюся последовательность цифр перенесите в бланк ответов № 1 без пробелов и других символов. (Цифры в ответе могут повторяться).
В задании В4: решите одну из задач. Ответом в задаче 1 является число, запишите его в бланк ответов. Если вы выбрали задачу 2, то напишите уравнения соответствующих реакций на отдельном листе.
В 1.Установите соответствие между формулой вещества и его названием
ФОРМУЛА ВЕЩЕСТВА | НАЗВАНИЕ ВЕЩЕСТВА |
A) СH3OH | 1) уксусный альдегид |
Б) CH3COOH | 2) этиловый спирт |
В) CH3- CH2 -OH | 3) уксусная кислота |
Г) CH3 -CHO | 4) метанол |
А | Б | В | Г |
Ответ (набор цифр без пробелов): ________________
В 2.Установите соответствие между названием вещества и классом (группой) органических соединений, к которому оно принадлежит (цифры могут повторяться):
НАЗВАНИЕ ВЕЩЕСТВА | КЛАСС (ГРУППА) ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ |
А) этиловый спирт Б) этиленгликоль В) 2-метилбутаналь Г) этилацетат | 1) алканы |
2) предельные одноатомные спирты | |
3) альдегиды | |
4) сложные эфиры | |
5) карбоновые кислоты | |
6) многоатомные спирты |
А | Б | В | Г |
Ответ (набор цифр без пробелов): ________________
В 3. Уксусная кислота взаимодействует с
1) Mg
2) Cu
3) Cu(OH)2
4) Na2CO3
5) C2H5OH
6) C2H6
В 4. Решите одну из задач
Задача №1. Объем водорода (н.у.), который выделится при взаимодействии магния массой 8 г с избытком уксусной кислоты, равен ________ л. (Ответ записать в виде целого числа с точностью до сотых).
Задача №2. В двух пробирках находятся вещества: этанол и уксусная кислота. Как распознать каждое из веществ? Напишите уравнения реакций.
Практическая часть.
Инструкция по технике безопасности
Работать с этанолом, глицерином необходимо так, чтобы не допустить попадания их на кожу, так как они могут вызвать ожоги.
Щёлочь (гидроксид натрия) – едкое вещество. Работать с ним необходимо аккуратно.
Зажжённую спиртовку нельзя переносить с места на место, нельзя также зажигать одну спиртовку непосредственно от другой. Для зажигания спиртовки пользуйтесь спичками.
Гасить спиртовку можно только одним способом – накрыть пламя фитиля колпачком. Колпачок должен находиться всегда под рукой.
Опыт 1. Окисление спиртов.
Медную проволоку внесите в верхнюю часть пламени спиртовки. Она покрывается слоем черного оксида меди (II). Составьте уравнение реакции.
Опустите проволоку в нижнюю часть пламени. Что наблюдаете? Какой запах ощущаете?
Составьте уравнение реакции окисления этанола.
Ссылки на видео с опытами:
https://www.youtube.com/watch?v=qfTP23_gnOk
https://www.youtube.com/watch?v=hJGvTj_ELn0&t=3s
https://www.youtube.com/watch?v=VKZvvFM1dW8&t=3s
https://www.youtube.com/watch?v=xtaH2zmR7IY
https://www.youtube.com/watch?v=X9ljOKH42tk&t=27s
https://www.youtube.com/watch?v=TSb3gN8i33w&t=24s
https://www.youtube.com/watch?v=VKZvvFM1dW8&t=3s
Опыт 2. Качественная реакция на многоатомные спирты.
Приготовьте свежий осадок гидроксида меди (II). Составьте уравнение реакции.
К осадку прилейте раствор глицерина, встряхните. Что наблюдаете?
Составьте уравнение реакции.
https://www.youtube.com/watch?v=4Ca953Y8wQo&t=1s
Опыт 3: Растворимость глицерина.
Налейте в пробирку 1см3 глицерина, добавьте столько же воды и встряхните. Затем добавьте в 2-3 раза больше воды. Перемешайте содержимое пробирки. Сделайте вывод о растворимости глицерина в воде.
https://www.youtube.com/watch?v=qZd0KCcm6zI
Опыт 4. Растворение фенола в воде.
Внимание: фенол очень ядовит! Обращаться с ним очень осторожно!
К 3-4 мл воды прибавьте столько кристаллического фенола, чтобы при взбалтывании образовалась мутная жидкость. Пробирку при этом закрывать пробкой. Раствор сохранить для опытов 4-6.
Задание: Запишите наблюдения и сделайте вывод о растворимости фенола в воде, связав это свойство со строением молекулы фенола.
https://www.youtube.com/watch?v=tVNHJ_oGSuw
Опыт 5. Взаимодействие фенола с хлоридом железа (III).
В пробирку с 1 мл водного раствора фенола, полученного в опыте 3, прибавьте 2-3 капли раствора хлорида железа (III). В какой цвет окрашивается раствор?
Задание: Напишите уравнение реакции взаимодействия фенола с хлоридом железа (III). Запишите наблюдения.
https://www.youtube.com/watch?v=MCK6J5CtY1M
Сделайте на основании проведенных опытов вывод о свойствах многоатомных спиртов и фенола, сравнив их со свойствами одноатомных спиртов.
Контрольные вопросы:1. Сколько изомерных соединений соответствует формуле С3H8O, сколько из них относится к алканолам? 3. Сколько первичных, вторичных и третичных спиртов приведено ниже? 4. Какой вид химической связи определяет отсутствие среди гидроксисоединений газообразных веществ (при обычных условиях)? 6. В каком порядке увеличивается кислотность следующих веществ: а) вода; б) метанол; в) пропанол-2; г) фенол; д) пара-нитрофенол? 8. Фенол не взаимодействует с веществом, формула которого 10. При дегидратации спирта образуется алкен симметричного строения, продуктом окисления которого раствором перманганата калия является ацетон. Укажите название спирта.
2. Какова формула гидроксисоединения, если оно содержит 37,5% углерода, 12,5% водорода (по массе) и имеет относительную плотность паров по метану, равную 2? CH3CH2OH C2H5CH(CH3)CH2OH (CH3)3CCH2OH (CH3)3COH CH3CH(OH)C2H5 CH3OH
5. Какое вещество образуется при нагревании этилового спирта до 140°С в присутствии концентрированной серной кислоты?
7. Водород выделяется в реакции ...
9. Укажите формулы продуктов А и Б в следующей схеме:










